Способностью вещества переходить в раствор (растворяться) является его растворимость (концентрация насыщенного раствора). На растворимость влияют множественные факторы: природа вещества, характер растворителя, внешние условия (температура, давление). Разделяют:
- малорастворимые вещества (растворимость менее 1 г на 100 г воды). Относят гипс, гашеную известь.
- нерастворимые вещества (менее 0,1 г на 100 г воды). Относят: сульфат бария, бромид серебра, карбонат кальция;
- легкорастворимые вещества (более 10 г на 100 г воды). К таким относят: поваренную соль, медный купорос, аммиак).
Необходимо помнить, что абсолютно нерастворимых веществ не бывает.
Влияние природы на растворимость веществ.
Издавна существовало правило: подобное растворяется в подобном. Т.е. спирты в спиртах, водные растворы – в воде, полярные соединения (альдегиды и т.д.) – в полярных растворах.
Растворимость газовых смесей в жидкостях варьируется в широких диапазонах. Например, в 100 объемах воды может раствориться 2 объема H2, 3 объема O2 и 700 объемов NH3.
Растворимость жидкостей в жидкостях зависит всецело от природы веществ. Модно выделить 3 класса жидкостей:
1. Жидкости, которые неограниченно растворяются друг в друге (воды – спирт, вода – уксусная кислота);
2. Жидкости, которые почти не растворяются друг в друге (вода – ртуть, бензол);
3. Жидкости, которые ограниченно растворяются друг в друге (вода – эфир, амин и т.д.).
Растворимость твердых веществ в жидких средах зависит от характера химической связи в кристаллической решетке. Молекулярные структуры имеют малую растворимость в воде, ковалентные неполярные соединения – не растворимы, а ковалентные полярные – растворяются.
Неорганические соли имеют различную растворимость в воде. Например, соли азотной и азотистой кислот, подавляющее большинство фторидов, бромидов и иодидов также хорошо растворимы, а вот соли угольной кислоты (кроме солей щелочных металлов и NH4+) – имеют малую растворимость.
Влияние температуры на растворимость веществ.
Существует основное правило: с повышением температуры растворимость всех твердых веществ повышается.

Приведенная зависимость показывает, что с повышением температуры растворимость данных содей увеличивается. Растворимость NaCl изменяется мало, о чем свидетельствует график.
Взаимная растворимость твердых веществ и жидкостей повышается с увеличением температуры. Ограниченная растворимость может перейти в неограниченную и наоборот.
Критическая температура растворения – такая температура, выше или ниже которой жидкости смешиваются между собой в неограниченных количествах.
Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается..
Примеры растворимости газов при различных температурах.
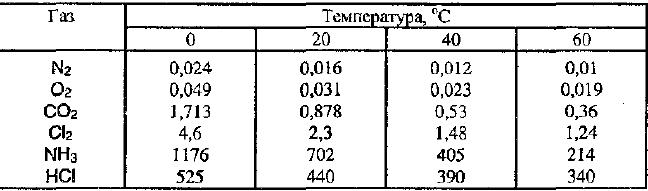
Влияние давления на растворимость веществ.
На растворимость газов больше влияние оказывает давление. При конкретных температуре и давлении газ растворяется до тех пор, пока скорость отрыва молекул газа от поверхности не станет равной скорости, с которой молекулы газа проникают в жидкость. В этот момент устанавливается равновесие, и жидкость становится насыщенным газом.
Зависимость растворимости газов описывается законом Генри:
При постоянной температуре растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью:
C(X) = Kr·P(X),
где С(Х) – концентрация газа в насыщенном растворе, моль/л;
Kr – постоянная Генри моль·л-1·Па-1;
Р(Х) – давление газа над раствором, Па.
Также вещества могут взаимно влиять друг на друга. Если раствор содержит электролиты, то вещества растворяются намного хуже, чем в простой воде.
Уменьшение растворимости газов в присутствие электролитов объясняется гидратацией ионов, вследствие чего понижается концентрация свободных молекул воды.