Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
Количественно такое состояние характеризуется константой равновесия. Для обратимой реакции можно записать так:

Где в соответствие с законом действующих масс скорость прямой реакции v1 и обратной v2 будут выглядеть следующим образом:
v1 = k1[A]m[B]n,
v2 = k2[C]p[D]q.
В момент достижения химического равновесия скорости прямой и обратной реакции становятся одинаковыми:
k1[A]m[B]n= k2[C]p[D]q,
или
K = k1/k2=([C]p[D]q)/([A]m[B]n),
где К – константа равновесия, показывающая отношение прямой и обратной реакций.
Те концентрации, которые останавливаются при равновесии, называются равновесными концентрациями. Следует помнить, что значения степеней m, n, p, q равны стехиометрическим коэффициентам в равновесной реакции. Численное значение константы равновесия определяют выход реакции. При К>>1 выход продуктов велик, а при К<<1 – очень мал.
Выход реакции – отношение количества получаемого в действительности продукта к тому количеству, которое получилось бы при протекании этой реакции до конца (выражается в процентах).
Химическое равновесие не может сохраняться бесконечно долго. В действительности, изменение температуры, давления или концентрации реагентов, могут сместить равновесие в ту или иную сторону.
Изменения, происходящие в системе в результате внешних воздействий, определяются принципом подвижного равновесия – принципом Ле Шателье:
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Т.е. изменяется соотношение между скоростям прямой и обратной реакции.
Принцип применим не только к химическим, но и к физическим процессам, такими как плавление, кипение и др.
Изменение концентрации.
При увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества.
Fe + S 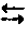 FeS,
FeS,
При увеличении концентрации железа или серы, равновесие будет сдвигаться в сторону расхода этого вещества, т.е. вправо.
Влияние давления на химическое равновесие.
Учитывается только в газовых фазах!
При увеличении давления равновесие смещается в сторону уменьшения количеств газообразных веществ. Если реакция протекает без изменения количеств газообразных веществ, то давление на равновесие никак не влияет.
N2 (г) + 3H2 (г) 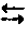 2NH3(г),
2NH3(г),
Слева 4 моль газообразных реагентов, справа – 2, поэтому при увеличении давления равновесие будет смещаться вправо.
N2(г)+O2(г) = 2NO(г),
Слева 2 моль газообразных веществ и справа, поэтому давление не влияет на равновесие.
Влияние температуры на химическое равновесие.
При изменении температуры изменяется как и прямая, так и обратна реакция, но в различной степени.
При повышении температуры равновесие смещается в сторону эндотермической реакции.
N2 (г) + 3H2 (г) 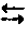 2NH3(г) +Q,
2NH3(г) +Q,
Эта реакция протекает с выделение тепла (экзотермическая), поэтому повышение температуры будет смещать равновесие в сторону исходных продуктов (обратная реакция).