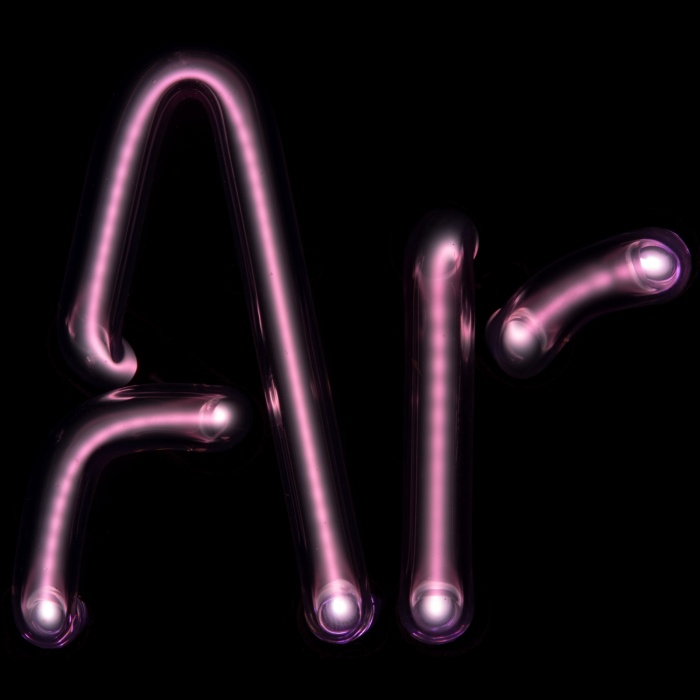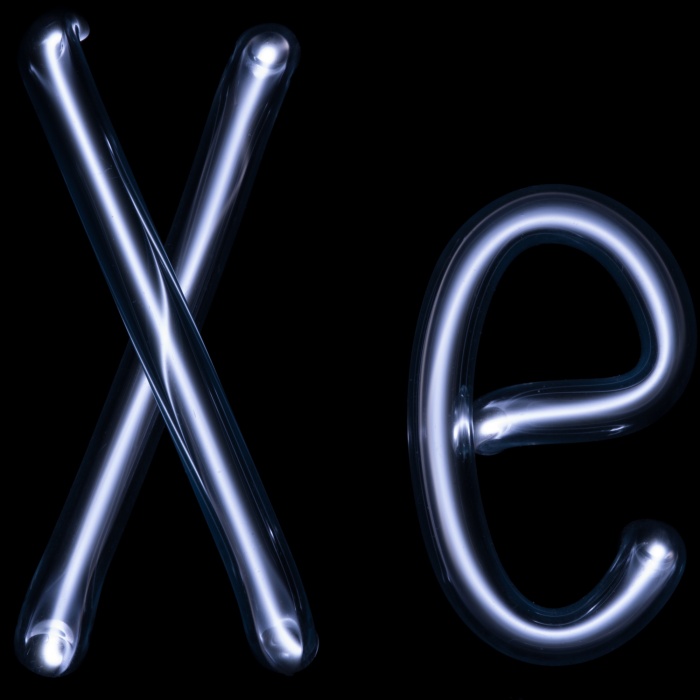Благородные газы (инертные либо редкие газы) — группа химических элементов с похожими свойствами: при нормальных условиях они являются одноатомными газами. Это химические элементы, которые образуют главную подгруппу 8-й группы периодической системы Менделеева.
При обычных условиях - это газы без цвета, вкуса и запаха, плохо растворимые в воде, не возгораются при нормальных условиях, с очень низкой химической реактивностью. Их температуры плавления и кипения закономерно увеличиваются с увеличением атомного номера.
Среди всех благородных газов лишь у Rn нет стабильных изотопов и только он является радиоактивным химическим элементом.
Редкими (инертными) газами являются:
- гелий (He) (атомный номер 2),
- неон (Ne) (10),
- аргон (Ar) (18),
- криптон (Kr) (36),
- ксенон (Xe) (54)
- радиоактивный радон (Rn) (86).
В последнее время к этой группе также причисляют унуноктий (Uuo) (118).
Все инертные газы собой завершают соответствующий период в Периодической системе и имеют полностью завершенный, устойчивый внешний электронный уровень.
У инертных газов электронная конфигурация ns2np6 (у гелия 1s2) и они образуют VIIIА группу. С возрастанием порядкового номера увеличиваются радиусы атомов и их способность к поляризуемости, что приводит к увеличению межмолекулярных взаимодействий, к увеличению Тпл и Ткип, к улучшению растворимости газов в воде и других растворителях. Для инертных газов существуют такие известные группы соединений: молекулярные ионы, соединения включения, валентные соединения.
Инертные газы относятся к последней при этом они занимают первые 6 периодов и относятся к 18-й группе в периодической таблице химических элементов. Флеровий - элемент 14-й группы показывает некоторые свойства благородных газов, поэтому он способен заменить в периодической таблице унуноктий. Благородные газы неактивны химически и могут принимать участие в химических реакциях только в экстремальных условиях.
Цвета и спектры инертных газов.
Цвета и спектры благородных газов. В первой строке таблицы изображены благородные газы в колбах, через которые пропущен ток, во второй — сам газ в трубке, в третьей — в трубках, которые изображают обозначение элемента в периодической таблице Менделеева.
|
Гелий |
Неон |
Аргон |
Криптон |
Ксенон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Распространенность инертных (редких) газов в природе.
Из-за того, что инертные газы обладают химической инертностью, их довольно долго не получалось обнаружить, и их открытие состоялось лишь во 2-й половине XIX века.
Гелий – является вторым (после водорода) по распространенности элементом во Вселенной, в земной коре содержание гелия составляет лишь 1 · 10-6 масс. %. Гелий является продуктом радиоактивного распада и содержится в пустотах горных пород и в природном газе.
Все благородные газы являются составляющими воздуха. В 1 м3 воздуха находится 9,3 л аргона, 18 мл неона, 5 мл гелия, 1 мл криптона и 0,09 мл ксенона. Солнце приблизительно на 10% состоит из гелия, образующийся из водорода по реакции ядерного синтеза:

(β+ - позитрон,  - антинейтрино). В спектре излучения Солнца довольно интенсивно проявляются линии гелия, которые были впервые обнаружены в 1868 г. На Земле гелий был найден только в 1895 г. при спектральном анализе газов, выделяющихся при растворении в кислотах минерала клевеита U2О3. Уран, входящий в состав минерала, самопроизвольно распадается по уравнению:
- антинейтрино). В спектре излучения Солнца довольно интенсивно проявляются линии гелия, которые были впервые обнаружены в 1868 г. На Земле гелий был найден только в 1895 г. при спектральном анализе газов, выделяющихся при растворении в кислотах минерала клевеита U2О3. Уран, входящий в состав минерала, самопроизвольно распадается по уравнению:
238U → 234Th + 4He.
В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Промышленное использование инертных газов основано на их низкой химической активности или специфических физические свойствах.
Некоторые характеристики элементов VIIIА подгруппы (инертных газов).
|
Элемент |
Радиус атома, нм |
Первый потенциал ионизации, эВ |
Tпл., K |
Tкип., K |
Относительная поляризуемость атома, усл. ед. |
Энергия возбужденного электрона, эВ |
|
Гелий, He |
0,122 |
24,58 |
– |
4,18 |
1 |
– |
|
Неон, Ne |
0,160 |
21,56 |
24 |
27,18 |
2 |
16,6 |
|
Аргон, Ar |
0,192 |
15,76 |
34 |
97,29 |
3 |
11,5 |
|
Криптон, Kr |
0,198 |
14,00 |
116 |
120,26 |
12 |
9,9 |
|
Ксенон, Xe |
0,218 |
12,13 |
162 |
166,06 |
20 |
8,3 |
Уникальными физическими свойствами обладает гелий. Во первых, это - единственное из известных в природе веществ, которое остается жидким при самых низких температурах, вплоть до 0 К. Он кристаллизуется только под давлением 25 атм. Во-вторых, гелий имеет самую низкую из всех веществ температуру кипения. Наконец, самое интересное свойство гелия - сверхтекучесть. При температурах ниже 2,2 К жидкий 4Не существует в виде смеси двух жидкостей, одна из которых имеет обычные свойства, а другая - аномальные. Сверхтекучая компонента жидкого гелия имеет практически нулевую вязкость (в 10 млрд. раз меньше, чем у воды). Это вещество способно просачиваться через мельчайшие отверстия в пористом сосуде, оно самопроизвольно вытекает из непористого сосуда, поднимаясь вверх по его стенкам, и обладает сверхвысокой теплопроводностью.
Электронное строение благородных газов.
|
Название |
Электронная конфигурация |
Радиус атома, нм |
Потенциал ионизации, эВ |
|
|
Гелий Не |
1s2 |
0,122 |
24,6 |
|
|
Неон Ne |
[Не]2s22p6 |
0,160 |
21,6 |
|
|
Аргон Аr |
[Nе]3s23p6 |
0,191 |
15,8 |
|
|
Криптон Кr |
[Ar]3d104s24р6 |
0,198 |
14,0 |
+2,+4 |
|
Ксенон Хе |
[Кr]4d105s25p6 |
0,209 |
12,1 |
+2,+4,+6,+8 |
|
Радон Rn |
[Хе]4f145d106s26р6 |
- |
10,8 |
+2,+4,+6 |