Хлор – элемент VII подгруппы Периодической таблицы Д.И.Менделеева. На внешнем уровне – 7 электронов, поэтому при взаимодействии с восстановителями, хлор показывает свои окислительные свойства, притягивая к себе электрон металла.
Физические свойства хлора.
Хлор представляет собой желтый газ. Имеет резкий запах.
Химические свойства хлора.
Свободный хлор очень активен. Он реагирует со всеми простыми веществами, кроме кислорода, азота и благородных газов:
Si + 2Cl2 = SiCl4 + Q.
При взаимодействии с водородом при комнатной температуре реакции практически нет, но как только освещение выступает в качестве внешнего воздействия, возникает цепная реакция, которая нашла свое применение в органической химии.
При нагреве хлор способен вытеснить йод или бром из их кислот:
Cl2 + 2HBr = 2HCl + Br2.
С водой хлор реагирует, частично растворяясь в ней. Эту смесь называют хлорной водой.
Реагирует с щелочами:
Cl2 + 2NaOH = NaCl + NaClO + H2O (холод),
Cl2 + 6KOH = 5KCl + KClO3 + 3 H2O (нагрев).
Получение хлора.
1. Электролиз расплава хлорида натрия, который протекает по следующей схеме:
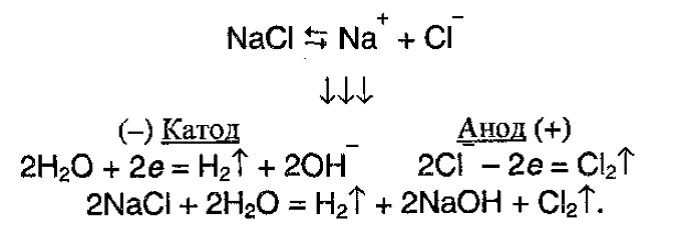
2. Лабораторный способ получения хлора:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.