Изотопы - элементы с одинаковым атомным номером, но с различным массовым числом А.
Изотопы имеют одинаковое строение электронных оболочек и занимают одно и то же место в периодической системе химических элементов.
Для названий и символов изотопов обычно используют названия и символы соответствующих химических элементов.
Верхний индекс указывает массовое число – сумму чисел протонов и нейтронов в ядре.
Нижний индекс – порядковый номер элемента в периодической системе химических элементов.
Изотопы записываются так (например, изотопы калия):
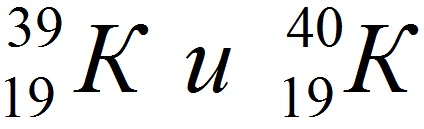 ,
,
Водород имеет три изотопа:
- протий
 .
. - дейтерий
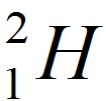 . Другое обозначение D.
. Другое обозначение D. - тритий
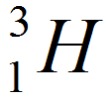 . Другое обозначение Т.
. Другое обозначение Т.
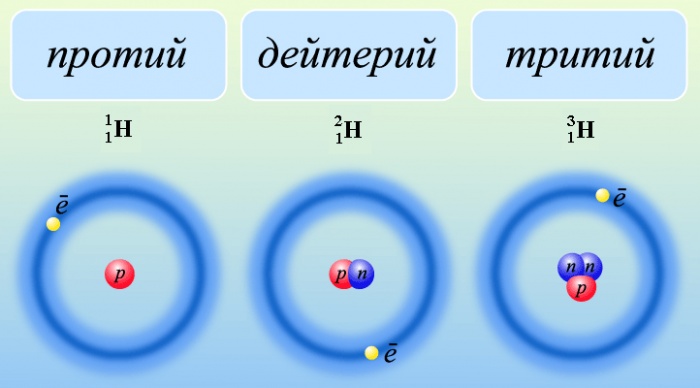
Углерод имеет три изотопа с массой 12, 13, 14, кислород также имеет три изотопа с массой 16, 17, 18.
Изотопы, имеющие одинаковые массовые числа, но различные заряды ядер, называются изобарами.
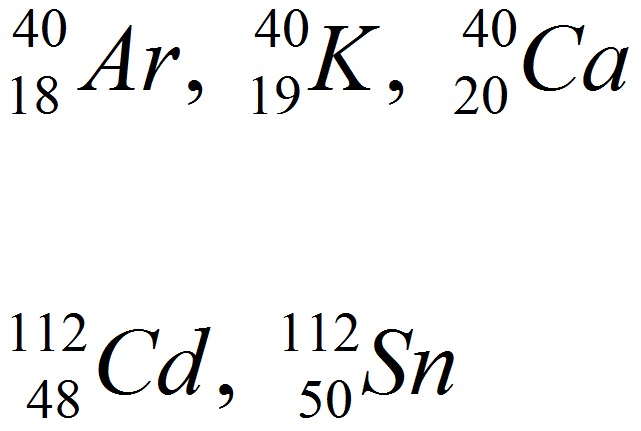 ,
,
На данный момент науке известно около 280 стабильных и более 2000 радиоактивных изотопов у 116 природных и искусственно полученных химических элементов.
Радиоактивность (от лат. radio – излучаю, radius – луч и activus – действенный), самопроизвольное превращение неустойчивого изотопа химического элемента в другой изотоп (зачастую – изотоп другого элемента), сопровождаемое испусканием ядер элементарных частиц.