Наборы значений квантовых чисел для различных атомных орбиталей:
|
Квантовое число |
Атомные орбитали |
|||
|
n |
l |
m |
Количество |
Обозначение |
|
1 |
0 |
0 |
Одна |
1s |
|
2 |
0 1 |
0 –1, 0, 1 |
Одна Три |
2s 2p |
|
3 |
0 1 2 |
0 –1, 0, 1 –2, –1, 0, 1, 2 |
Одна Три Пять |
3 3р 3d |
|
4 |
0 1 2 3 |
0 –1, 0, 1 –2, –1, 0, 1, 2 –3, –2, –1, 0, 1, 2, 3 |
Одна Три Пять Семь |
4s 4p 4d 4f |
При заполнении электронами атомных орбиталей соблюдаются следующие три правила:
1. Принцип устойчивости (принцип минимальной энергии). Орбитали заполняются начиная с имеющих самую низкую энергию и далее в порядке её повышения. В этом случае энергия атома является минимальной, а устойчивость – максимальной.
энергетическая последовательность легко может быть описана при помощи правила суммы двух первых квантовых чисел n+l. Это правило носит название правила Клечковского (1951 г.):
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного (орбитального) квантового числа l, т.е. n+l, имеет меньшее значение.
Например, орбиталь 4s, для которой n+l = 4+0 = 4, заполняется раньше, чем орбиталь 3d, где сумма n+l = 3+2 = 5.
При равенстве сумм ниже по энергии находится орбиталь с меньшим значением главного кантового числа. Так, орбиталь 3d имеет более низкую энергию, чем 4р.
Обычный порядок заполнения атомных орбиталей:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f =5d < 6p < 7s < 5f=6d …
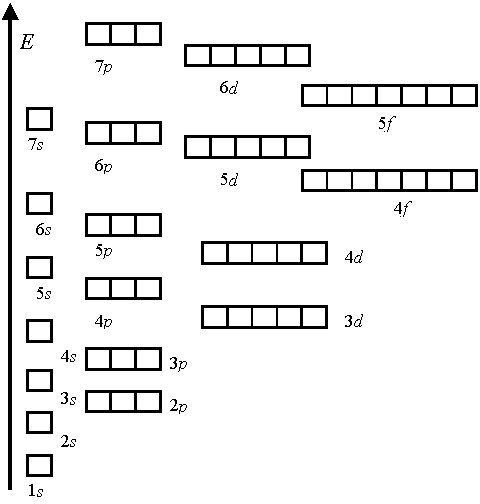
Количество орбиталей на каждом электронном уровне.
2. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовые числа были бы одинаковыми.
На любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположно направленные спины. Такие электроны называются спаренными.
3. Правило Хунда (1925 г.). Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.

Заполнение энергетических орбиталей азота: а - правильная схема, б - неправильная схема.